【Nanosensors】
奈米感測器已廣泛被應用偵測生物大分子及有機小分子,最近利用於溶液中金屬含量的檢測也漸漸受到重視。金奈米粒子(gold nanoparticles, Au NPs) 是目前受歡迎奈米材料之一,因其具備生物安全性、穩定性、特殊光學活性、高的表面電漿子共振(Surface Plasmon Resonance, SPR) 吸收係數 (108-1010 cm-1mol-1L)、消光(quenching)特性及表面易於被辨識分子修飾 (和硫醇分子間有較強的Au-S 作用力)等優勢。近年來,我們已開發許多以金為主之奈米感測器,並利用於湖水和電池等實際樣品中汞含量之偵測以及蛋白質及三磷酸腺苷小分子之檢測工作。
1. Au NPs之汞離子感測器
我們以 Au NPs 所開發之汞離子感測器,主要利用其三種特性:其一為當汞離子和Au NPs所修飾之辨識分子作用時,造成 Au NPs交聯聚集而產生表面電漿共振吸收峰變化,即聚集時會造成表面電漿共振吸收峰發生紅位移現象,可直接藉由肉眼觀測溶液顏色改變。其二則是利用 Au NPs 之高消光(quenching) 特色,藉由Au NPs具有較大的表面電漿共振吸收係數結合螢光共振能量轉移 (fluorescence resonance energy transfer, FRET) 之機制來偵測汞離子。另外,利用螢光金奈米微粒(fluorescent Au nanodots, FAuNDs)與汞離子結合後,由螢光變化來偵測汞離子。
由於羧酸基(carboxylate)和重金屬(鉛、鎘、汞離子)皆有不錯的鍵結能力,因此將3-巰基丙酸(3-Mercaptopropionic acid, MPA)修飾在13-nm Au NPs (MPA-Au NPs)上後,當溶液中存在有這些重金屬離子時,便會使 MPA-Au NPs 因交聯(cross-link) 產生聚集並造成顏色變化 (由酒紅色轉變為藍紫色)。為了增加此金奈米感測器對汞離子之選擇性,於溶液中加入和汞離子有較強鍵結之2,6-吡啶二甲酸試劑(2,6-pyridinedicarboxylic acid, PDCA)。由於 PDCA 和汞離子之結合常數高達1020.28,因此我們可以藉由此方式,除去鉛及鎘離子之干擾,達到對汞離子具專一性之偵測,其偵測極限(LOD)為100 nM (圖一)。
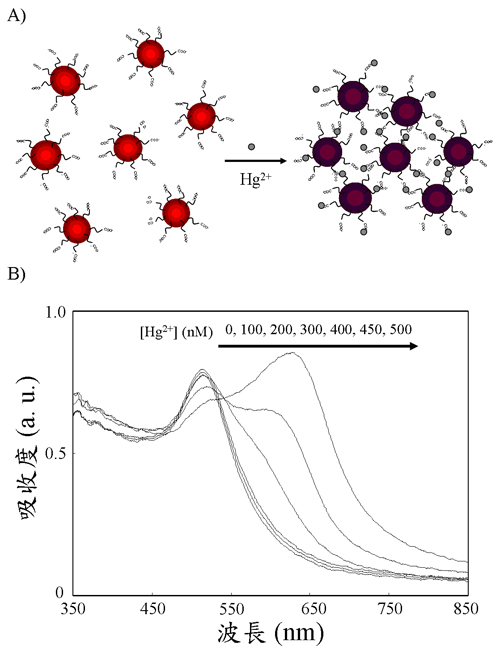
圖一. (A) 利用MPA-Au NPs以吸收光譜法偵測汞離子之機制圖。(B)汞離子濃度對MPA-Au NPs吸收圖譜之變化。
我們將具有硫醇官能基之特殊DNA序列修飾於Au NPs表面,在含有染料分子(OliGreen, OG)存在下,由於OG-DNA螢光完全被Au NPs消光,因此無法偵測到染料分子之螢光。當溶液中汞離子藉由T-Hg2+-T作用力將Au NPs表面之DNA取代出來後,OG-DNA螢光強度與汞離子濃度(0.05–2.5 μM)呈線性關性,其偵測極限為25 nM(圖二)。應用於湖水的定量上,其回收率高達96-102%,證明此Au NP感測器具備高靈敏度及低基質干擾之優勢。
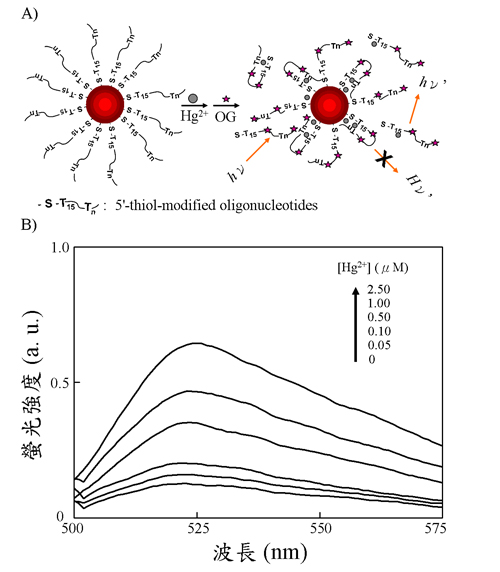
圖二. (A) 利用特殊DNA序列修飾於Au NPs以螢光光譜法偵測汞離子之機制圖。(B)汞離子濃度對修飾DNA序列Au NPs之螢光圖譜變化。
2. Au NPs之蛋白質感測器
先前實驗室已經成功利用尺寸為2.0 nm的11-MUA-AuNPs作為會發螢光之金奈米粒子(LAuND),將此表面修飾上血小板原生長因子AA (PDGF AA)之奈米粒子作為螢光的施體,再利用修飾對PDGF具專一性之適合體(aptamer)修飾於13 nm金奈米粒子上(Apt-QAuNP)作為受體,以螢光共振能量轉移作為偵測之模型,如圖五所示。若在一般情況下將此兩種金奈米子混合時,13 nm 金奈米粒子會作為消光劑(quencher)使PDGF AA -11-MUA-AuNPs (PDGF AA-LAuND)所發出的520 nm螢光消失。當溶液中存在PDGF時,PDGF AA-LAuND與Apt-QAuNP之間的作用力會因為Apt-QAuNP與PDGF之間會有鍵結而減弱,因此藉由競爭性作用,反可使PDGF AA-LAuND螢光被消光現象減弱;此外,當添加PDGF α-受體時(PDGF α-receptor),此兩種不同尺度的奈米粒子也會因為PDGF α-receptor與PDGF AA-LAuND鍵結而減少消光作用。在本實驗中對於PDGF AA與PDGF α-receptor之偵測極限可達80 pM與 0.25 nM,並且此種分析方法,也可以有效分析尿液中與細胞培養基(cell medium)中PDGF的含量。
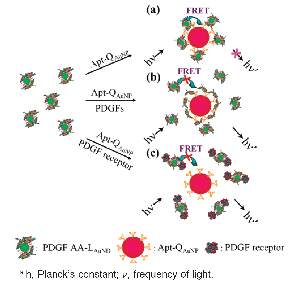
圖三:(a) PDGF AA-LAuND 與Apt-QAuNP 辨識後,由於螢光共振能量轉移導致小金螢光下降、(b)已存在之PDGF 與PDGF AA-LAuND競爭Apt-QAuNP,降低消光作用、(c)PDGF之受體,先與PDGF AA-LAuND作用後,抑制與Apt-QAuNP的作用,亦可減弱螢光共振能量轉移之作用。
3.Aptamer修飾 Au NPs
我們利用表面修飾凝血酶核酸適合體金奈米粒子能抑制凝血酶的活性,藉由改變金奈米粒子表面適合體的密度可調控抑制劑的活性,並且能穩定存在於血漿中,不受生物樣品中核酸酶的降解,有效地延遲凝血的時間,並將適合體的互補序列修飾在金奈米粒子上做為解毒劑,使被抑制凝血酶活性再度恢復,藉由調控兩者比例,可調控凝血酶活性的表現。
常見的凝血酶適合體是15個鹼基的TBA15與27個鹼基長的TBA27,這兩股適合體會形成G-quadruplex,其立體構形像是椅子的結構,分別會專一性辨認凝血酶的exosite I及exosite II(Scheme 1A-1B)。TBA15會抑制凝血酶的活性,是因為纖維蛋白原(fibrinogen)被凝血酶剪切形成纖維蛋白前,會辨認到exosite I,先與exosite I結合,再靠近凝血酶的活性中心(active site),進而FpA與FpB被剪切。若是TBA15占據了exosite I,會干擾纖維蛋白原靠近凝血酶活性中心,因此可抑制凝血反應,但TBA15為一條單股寡核苷酸,易被血液中的核酸酶分解成更小片段。TBA15與凝血酶的解離常數(dissociation constant,Kd)約100–400 nM,與纖維蛋白原與凝血酶的解離常數相近(約1.0 μM)。在溶液中TBA15與纖維蛋白原競爭exosite I,而非緊緊結合在exosite I,因此若想要提高其抑制凝血酶的效果必須要增強核酸適合體與凝血酶間的親和力。雖然TBA27結合在離活性中心較遠的exosite II,無法抑制凝血酶活性,但TBA27與凝血酶有較強的結合力,其解離常數約700 pM。有文獻指出,將TBA15與TBA27以一段特定長度的寡核苷酸的連接端(linker)串連起來,藉由TBA27與凝血酶的強結合力,增加TBA15靠近exosite I的機會,結果其延長凝血的時間約是單純TBA15的9倍。本研究將TBA15或TBA27序列修飾在Au NPs上(Scheme 1C),由於奈米粒子的尺寸小且具較大的比表面積,可在同一顆金奈米粒子上修飾多條的核酸適合體,利用此種多價配位基修飾的奈米粒子,大幅提升對凝血酶的親和力且無須去調控連接端的長度,即可達到更好的抑制凝血效果。
另外,核酸適合體不僅有容易製備、性質穩定與立體結構可預測等優點,利用其互補的核酸序列,調控其與目標分子鍵結的特性。例如當以TBA27-Au NPs抑制凝血酶作用後,可加入TBA27的互補序列(complementary sequences,cTBA27),原本形成椅子形立體結構的TBA27,根據華生克立克鹼基配對(Watson-Crick base paring)原則會與其互補序列作用,形成雙股螺旋結構,此時核酸適合體對凝血酶的親合力下降,無法有效抑制凝血酶作用,故cTBA27就扮演著解毒劑(antidote)的角色(scheme 1D)。
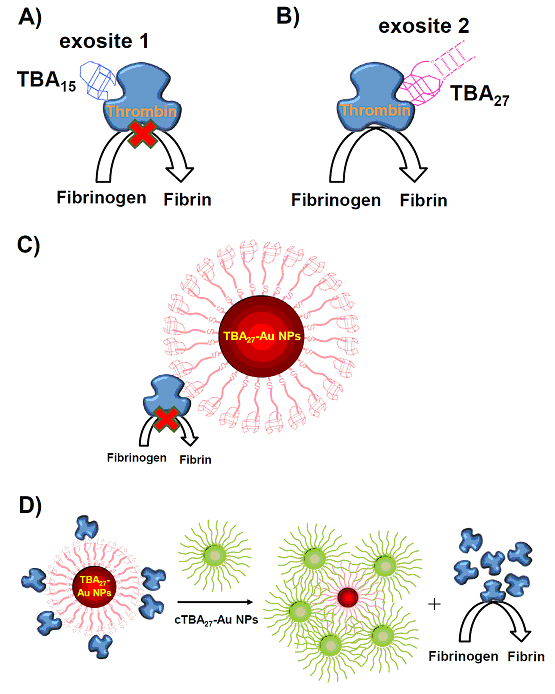
Scheme 1