蔡蘊明於臺大化學系 (2014/04/17)
二氧化碳的議題,想必大家都不會陌生。人類靠電來推動科技,而目前最大宗的電源是來自於火力發電,除了消耗地球的資源外,隨伴著產生大量的二氧化碳,這方面當然也不能忽略車輛和工廠扮演的角色。許多科學家相信這造成了地球的暖化,若不及早處理,終將導致一場浩劫。事實是用2013年的全球二氧化碳排放量來與1990年的比較,已經增加了0.9倍,以這樣的速率增加,在我們大家幾乎都可親自體驗的十年之後,地球環境的狀況將不可想像!例如大氣二氧化碳的濃度增加,除了溫室氣體效應,造成全球暖化,亦將導致溶入海洋的二氧化碳濃度升高,隨伴產生的碳酸,濃度也會增加,海洋生態就受到雙重的衝擊,有興趣的讀者可以參看四月十四號出刊的時代雜誌,其中就有一篇與珊瑚礁相關的文章。
想當然爾的解決之道,一個就是節約以及更有效率的使用能源,但若是站在民眾的角度來看,事關民生需求和享受,誰願犧牲?開發中國家更急於發展經濟,節約用電根本就是奢談。因此不會意外的,發展二氧化碳的回收和儲存技術,是先進國家著重的研究課題。
站在化學的立場來看,火力發電廠以及車輛的能量來源,倚賴的是進行有機化合物的氧化分解,最終產生碳的氧化物,亦即二氧化碳,看似廢物,但實可將之視為碳的來源,若能發展出有經濟效益的化學方法,將二氧化碳轉回有用的有機物質,搭配二氧化碳的回收科技,那就有機會建立一個永續的碳循環。最理想的二氧化碳的回收再轉換,所需使用的能源最好是來自太陽能,再配合催化劑的發展,更進一步降低能量的耗費,這是化學家們的夢想,而且是有機會達成的。
二氧化碳的捕捉和儲存(carbon capture and storage,簡稱CCS)
二氧化碳的捕捉目前算是成熟的科技,接著壓縮應不困難,但是透過船隻或管線輸送,儲存到地底下廢棄的油田和天然氣礦場或含鹽層(saline formation),仍需評估和發展。這乃是權宜之計,只是成熟的低碳科技發展成型前的過渡作法。即便如此,離商轉仍有距離,現在仍未見這種大型的回收與儲存設施。以下簡單介紹幾種與化學有關的作法:
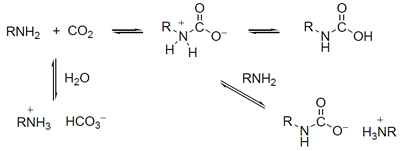
圖1 利用胺類的化合物做為溶劑來吸收二氧化碳,加熱則逆向釋放出二氧化碳。
燃燒後捕捉法
燃燒之後產生的廢氣(或稱煙道氣;flue gas)不是只有二氧化碳,還包括氮氣、氧氣和水蒸氣等等,因此需要將之分離,常見的作法是利用胺類的化合物做為溶劑來吸收二氧化碳(圖一),之後透過加熱釋放出來,如此所得到的二氧化碳已經夠純,不需再處理而可直接儲存。但這個作法是需要耗費能量的,目前大約要花掉發電廠25%的能量,因此仍無大型商轉設施。
其它的作法包括利用薄膜的科技進行氣體的分離,或者是使用固體的吸附劑,這些都需要新材料的開發,仍在研究階段。另有一具潛力的新技術,使用化學循環法(chemical looping),如圖二所示,先使用金屬粉末顆粒與氧氣反應產生金屬的氧化物,再將金屬的氧化物通入燃燒室,此時煤炭與之進行反應,碳被氧化產生二氧化碳,金屬氧化物則被還原變回金屬,不但產生的二氧化碳很純,得到的金屬還可循環使用。這個方法避開通入空氣或是純的氧氣,間接的利用金屬氧化物來提供氧,也就避開氣體純化的問題。若是使用石油或天然氣,產生的水蒸氣要分離不會困難。不過這個方法牽涉到固體金屬以及金屬氧化物摩擦反應腔體和輸送管道造成的損害問題,仍須工程師的設計來克服。
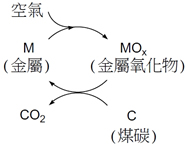
圖2 化學循環法利用金屬先與空氣中的氧反應成其氧化物,再將金屬的氧化物通入燃燒室,與煤炭進行氧化還原反應,產生純的二氧化碳以及可再循環使用的還原態金屬。
燃燒前捕捉法
這種方法是先將煤炭進行不完全燃燒,產生一氧化碳和氫氣(稱為水煤氣),接著通入水蒸氣與一氧化碳進行水煤氣轉化反應(water-gas shift reaction;見式1),產生氫氣和二氧化碳,透過吸附移除二氧化碳,剩下的氫氣則做為燃料。
CO + H2O → CO2 + H2 (式1)
此法面臨的課題,包括二氧化碳的分離,降低此法耗費的能量,以及設計適用氫氣做為燃料的機具,這些都仍須研發。
燃氧捕捉法(oxyfuel capture)
此法基本上需要用純的氧氣與石油或天然氣進行燃燒,產生的煙道氣因仍含有過多的氧氣,會循環使用,好處是最終只會產生二氧化碳和水蒸氣。然而製造純的氧氣是很耗能的,爐具的設計也仍須改進
二氧化碳的再利用
要將二氧化碳進行化學反應,首先我們應了解它是一個非常穩定的化合物,因此要將之轉換成為其它有用的化學品大多是很耗能的,因此發展適當的催化劑來降低能量的耗費是很重要的。此外,如果耗費的能量是來自於天然的碳資源,那將仍然無法達到碳均衡的目的,因此透過太陽能來取得能量也是重要的方向。 目前工業上將二氧化碳轉換所得的製品,包括一些無機碳酸鹽、尿素、水楊酸、碳酸伸乙酯(ethylene carbonate)、碳酸丙烯酯(propylene carbonate)、和碳酸酯聚合物(圖三)。當然除了製造這些產品,二氧化碳還有許多其它的用途,如何擴大它的使用是一個必須走的方向。
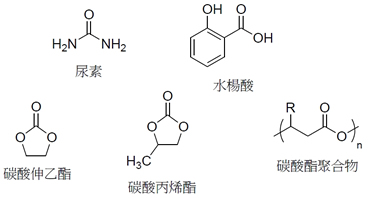
圖3 幾個現在工業上從二氧化碳大量製得之有機化學品
CH4 + H2O → CO+ 3H2 (式2)
理想上,如果能將二氧化碳很有效率的轉換成為甲醇、甲烷或高碳數的碳氫化合物,將可達到循環使用的目的,其中甲醇更可以用來合成許多有用的有機化合物,再一度的,前提是這些轉換不能因為耗費火力發電的能源,導致更多二氧化碳的排放。上述的幾個轉換屬於還原反應,原則上可以使用氫氣以及發展適當的催化劑來達成,現在工業界使用的氫氣來源是透過甲烷的蒸氣重組反應(steaming reforming;式2),所得到的氫氣和一氧化碳,再經過上面提及的水煤氣轉化反應(式1)得到更多的氫氣,但同時產生二氧化碳。由於甲烷的蒸氣重組反應是個吸熱反應,相當耗能,但氫氣其實也可以透過水的電解而得,若能搭配太陽能,將會是很理想的氫氣來源;以下簡介上述幾個還原反應目前之發展。
二氧化碳與氫氣合成甲烷或高碳數的碳氫化合物
目前用氫氣將二氧化碳還原成甲烷所使用的催化劑,活性和選擇性最好的,應屬釕(Ru)附著在TiO2擔體上之系統。有關合成高碳數的碳氫化合物,在此先介紹費雪-闕布希法(Fischer-Tropsch process),這是一個工業上將一氧化碳與氫氣轉換成為高碳數碳氫化合物的重要方法(式3),常用的催化劑是鐵、鈷和釕的系統。
n CO + (2n+1) H2 → CnH2n+2 + n H2O (式3)
由於費雪-闕布希法是已經存在的工業法,因此尋找催化系統,能將二氧化碳先轉換成一氧化碳的中間物,接著進行費雪-闕布希法,就有機會直接合成高碳數的碳氫化合物。目前鐵的系統效果最好,但產生甲烷副產物仍是主要的問題,選擇性仍待提高。
二氧化碳與氫氣合成甲醇
工業界合成甲醇是透過一氧化碳和氫氣反應而得,使用的催化劑是利用一些金屬搭配銅或鋅的氧化物,例如Cu/ZnO/Al2O3,反應溫度為230-280 oC,壓力為50-120 atm,同樣的組合也可用來將二氧化碳還原成甲醇,但目前甲醇的產率還不夠高。雖然這種製程在三十年前就已經可行,但商轉也是到了2011年才開始出現。研究顯示催化劑擔體的型態(morphology)與催化劑的活性息息相關,化學家對此類反應的反應機構亦不斷的研究,更搭配理論計算去尋找最佳的催化劑。
反應機制的研究顯示上例催化劑中銅是主要的活性位置,ZnO則是重要的擔體,它影響銅的型態以及穩定銅那個重要的活性型態。Al2O3則有促進活性和選擇性的效果,這可能是有助於銅的分散。
其它的方法
利用電解的方法亦可將二氧化碳還原成各種化合物,此法還可搭配太陽能所產生的光電。在此方向上,二氧化碳對水的溶解度不夠高是一個需要克服的問題。電極材料影響效率,也仍在發展中,另外也需要好的催化劑來搭配。
不會意外的,透過藍綠藻的方法,利用陽光和生物將二氧化碳轉換成為油脂類的化合物,成為另一個受到高度重視的研究課題。
最新的發展
將二氧化碳以氫氣還原得到甲醇還有另一重要意義,實際上氫氣也是一種燃料,但是問題在於輸送,它算是危險的物質,加上是氣體,輸送還需壓縮,這都增加成本。轉換成甲醇這種液態的燃料,既安全又方便輸送,因此這種技術也可以看成將氣體燃料液化的方法。
上述使用Cu/ZnO/Al2O3為催化劑的方法,需要用高溫高壓,若希望未來一些較小型的工廠也能使用,在地產生氫氣同時轉換成為甲醇,就有需求尋找新的催化劑,希望能在室溫以及室壓即可進行。另一個需要考慮的就是逆向的水煤氣轉化反應(式1)的發生,那將會產生一氧化碳,若是產生的甲醇內有一氧化碳,則當使用甲醇做為燃料電池的燃料時會出現問題,因為燃料電池使用的鉑(Pt)催化劑會被一氧化碳毒化而喪失活性,是而新的催化劑還必須要有很高的選擇性,不可產生一氧化碳。
最近在Nature Chemistry這份期刊上發表了一篇文章(參考資料5),史丹福大學Norskov所領導的研究小組,先透過電腦的計算發現鎳(Ni)-鎵(Ga)的組合是很有潛力的催化劑,接著透過實驗,以不同的Ni-Ga比例放在SiO2擔體上來測試,找到Ni5Ga3真的具有很好的活性,與Cu/ZnO/Al2O3相比,此一新的系統之活性更好,而且不會產生很多的一氧化碳。這種催化劑相當穩定,其催化可以在室壓進行。
這組研究人員認為Cu-Zn的系統中,Cu的活性需要Zn的促進,但這種活性位置不多,Ni5Ga3則無此問題,因此活性較高。他們發現新催化劑中Ga的位置是產生甲醇的所在,而Ni則是產生一氧化碳和甲烷的位置,但是當反應進行一陣之後,產生的一氧化碳會與Ni強烈結合產生毒化效應,這是造成此系統具有良好選擇性的原因。此催化劑經使用而活性降低之後,還可回收,透過氫氣在350 oC處理兩小時可恢復原來活性。
雖然此一催化劑尚非完美,但不可否認的,這份工作找到了一個全新的系統,開創了很好的機會。透過計算的方式而能成功的找尋到有用的催化劑,是另一個讓人印象深刻的例子,但若非許多其他研究者在反應機制方面所得之研究成果,做為計算的依據,理論計算也不會如此的有用。另外要注意,這兩種金屬均非貴重金屬,這也是非常重要的。
總結
如何將二氧化碳以不耗費碳資源的方式轉換成為有用的有機物質,絕對是化學家需要努力追求的。要達成此一目標有賴催化劑的發展,那是另一個需要關注的領域。這些方面的科技發展,將影響地球生態的存續,絕不能忽視。
註解參考資料
- 有關二氧化碳的捕捉和儲存,請參考國際能源組織網站提供的文章:http://www.iea.org/publications/freepublications/publication/name,3847,en.html
- Kondratenko, E. V.; Mul, G.; Baltrusaitis, J.; Larrazábalc, G. O.; Pérez-Ramírez, J. Energy Environ. Sci., 2013, 6, 3112–3135.
- Ganesh, I. Materials Science Forum 2013, 764, 1-82.
- Grabow, L. C.; Mavrikakis, M. ACS Catal. 2011, 1, 365–384.
- Studt, F.; Sharafutdinov, I.; Abild-Pedersen, F.; Elkjar, C. F.; Hummelshoj, J. S.; Dahl, S.; Chorkendorff, I.; Norskov, J. K. Nature Chemistry, 2014, 6, 320-324.
- 有關理論計算對化學的幫助,請參考2013年諾貝爾化學獎簡介:http://www.ch.ntu.edu.tw/nobel/2013.html